Тема: Вуглеводні: алкани, алкени, алкіни, алкадієни, арени.
а) навчальна: розглянути вуглеводні: алкани, алкени, алкіни, алкадієни, арени;
б) розвиваюча: вміння систематизувати й використовувати власні знання, формувати в учнів логічне мислення;
в) виховна: сприяти формуванню наукового мировозору, комунікативної та інформаційної компетентності.
Обладнання та матеріали: схеми.
Базові поняття й терміни; алкани, алкени, алкіни, алкадієни, арени.
Форми та методи проведення заняття:
а) словесний: розповідь, бесіда;
б) наочний: ілюстрація.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення.
Тип уроку: засвоєння нових знань
Міжпредметні звязки: фізика, трудове навчання.
Література:
1. Попель П.П., Крикля Л.С., 10 клас: Підручник для загальноосвіт. навч.закл. – Київ: Академія, 2010. – 208 с.
2. Буринська Н.М.,Величко Л.П., 10 клас: Підручник для загальноосвіт. навч.закл. – Київ: Перун, 2004. – 192 с.
План
1.Загальна характеристика алканів.
2. Загальна характеристика алкенів.
3. Загальна характеристика алкінів
4. Загальна характеристика алкадієнів.
4. Загальна характеристика аренів.
Структура заняття
І. Організаційний етап
Викладач налаштовує групу на роботу, перевіряє готовність студентів до заняття, відмічає в журналі відсутніх. Студенти готуються до заняття, чергові подають інформацію про відсутніх.
II. Повідомлення теми, мети і завдань заняття
Викладач повідомляє студентам тему, мету та завдання заняття. Студенти записують тему та план заняття в зошити.
III. Актуалізація опорних знань і мотивація навчальної діяльності.
Вуглево́дні — органічні речовини, аліфатичні, аліциклічні та ароматичні сполуки, до складу молекул яких входять лише атоми вуглецю і водню.
Вони утворюють гомологічні ряди. У природі вуглеводні зустрічаються в рідкому, твердому і газоподібному стані. У розсіяному вигляді присутні в атмосфері, воді, твердих породах (кероген), в концентрованому — у покладах вугілля, нафти, газу, газогідратів.
Ви вже знаєте, що залежно від будови розрізняють ациклічні вуглеводні, в молекулах яких атоми утворюють лінійні або розгалужені ланцюги, та ізоциклічні. (карбоциклічні), молекули яких являють собою цикли (кільця) трьох і більше атомів С.
IV. Вивчення нового матеріалу
1.Загальна характеристика алканів.
Алкани, насичені вуглеводні — насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами. Більшість їх хімічних реакцій з різними реагентами починається з розриву зв'язку С-Н, тоді як їх розпад при високих температурах йде передусім по зв'язках С-С. Алкани складають значну частину вуглеводнів нафти і природних горючих газів. За агрегатним складом алкани діляться на газоподібні (С1-С4), рідкі (С5-С17) і тверді (починаючи з С18), що кристалізуються при 200 °C.
Фізичні властивості
Г а з о п о д і б н а. здатні з водою утворювати, особливо під тиском, молекулярні сполуки — газогідрати, для яких температура розкладу при тиску 0,1 МПа і критична температура відповідно рівні: з метаном — 29 і 21,50 °C, з етаном — 15,8 і 14,50 °C, з пропаном 0 і 8,50 °C.
Р і д к а. особливо нормальної будови, можуть у порівняно м'яких умовах окиснюватися киснем повітря. Вони є компонентами моторного палива: бензину, газотурбінних (авіаційних, наземних, морських) і дизельних.
Т в е р д а. виділяються із нафтової сировини при виробництві змащувальних олив, оскільки вони викристалізовуються із оливи, зменшуючи її рухомість і зумовлюючи застигання при високих температурах. Тверді алкани діляться на дві групи речовин — власне парафін і церезин.
До насичених вуглеводнів належать метан CH4, етан C2H6пропан C3H8, бутан C4H10 і багато інших, які за своїми хімічними властивостями подібні до метану. Легкі алкани, наприклад, метан, етан, пропан і бутан — це безбарвні гази; більш важкі — рідини або тверді речовини. У природі вони зустрічаються в природному газі і нафті. Оскільки алкани мають тільки один ковалентний зв'язок, вони називаються насиченими.
Якщо формули насичених вуглеводнів написати в ряд за збільшенням атомів вуглецю, то одержимо так званий гомологічний ряд насичених вуглеводнів, або вуглеводнів ряду метану. У цьому ряді кожний наступний вуглеводень відрізняється від попереднього наявністю в складі молекули однієї і тієї самої групи атомів CH2.
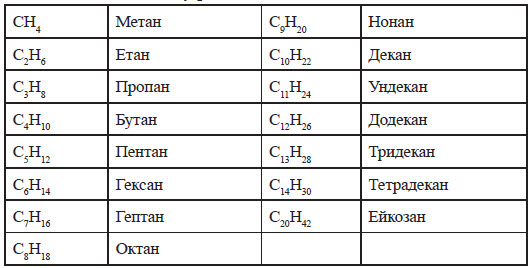
Хімічний склад насичених вуглеводнів можна виразити однією загальною формулою CnH2n+2, де n — число атомів вуглецю, а 2n+2 — число атомів водню. Назви насичених вуглеводнів мають закінчення -ан. Ці назви, за винятком перших чотирьох гомологів, складаються з грецьких назв числівників, які показують кількість атомів вуглецю в молекулі вуглеводню, і закінчення -ан.
1.Галогенування алканів. Реакція галогенування органічних сполук – введення атомів галогену в молекулу, що призводить до утворення зв’зку С‑Нal.
Для введення галогену в молекулу алкану використовують їх реакцію з галогенами, при цьому реакційна здатність галогенів зменшується в ряду Cl2 > Br2 > I2. Найактивніше реагує з алканами хлор, бромування відбувається повільніше, а з йодом алкани практично не реагують. Хлор, як і інші галогени, за звичайних умов і у темряві з метаном не реагує. Хлорування метану відбувається на світлі, ще краще – під дією УФ-світла. Реакцію можна проводити і у темряві, для чого необхідно нагріти суміш метану з хлором до температури 250 – 4000 С.
При взаємодії метану з хлором відбувається послідовне заміщення усіх атомів Гідрогену на атоми хлору, при цьому утворюється суміш чотирьох продуктів/
Незважаючи на те, що без каталітичного впливу світла чи нагрівання метан з хлором не взаємодіє, хлорування метану (коли воно вже розпочалося) може відбуватись навіть з вибухом.
2. Нітрування алканів. Реакція нітрування – введення нітрогрупи (–NO2) в молекулу органічної сполуки. Алкани за нормальних умов не взаємодіють з концентрованою нітратною (азотною) кислотою. При нагріванні алкани розщеплюються по зв’язку С–С з утворенням суміші продуктів нітрування та окиснення, яку практично неможливо розділити. Російський хімік-органік М.І. Коновалов запропонував проводити нітрування алканів розбавленою нітратною кислотою при підвищеній температурі і тиску:
CH4 + HNO3р.  CH3NO2 + H2O
CH3NO2 + H2O
нітрометан
3. Окиснення алканів. Як уже зазначалось, алкани за звичайних умов не окиснюються. На них не діють ні кисень, ні такі сильні окисники, як хромова кислота чи калій перманганат.
CH4 + 2O2  CO2 + 2H2O + 890 кДж/моль
CO2 + 2H2O + 890 кДж/моль
2. Загальна характеристика алкенів.
Перші представники вуглеводнів етиленового ряду – етен, пропен, бутени – гази, олефіни складу С5 – С18 – безбарвні рідини, вищі представники – тверді речовини. Етиленові вуглеводні практично не розчинні у воді, добре розчинні у вуглеводнях.

На відміну від алканів, алкени є високореакційноздатними сполуками. Це зумовлено наявністю в їх структурі подвійного зв’язку С=С, який складається з s- та p-зв’язків.
1.Приєднання водню. Приєднання водню (реакція гідрування) до алкенів проводять у присутності каталізаторів. Найчастіше використовують подрібнені метали – платину, нікель, паладій та ін. В результаті утворюються відповідні алкани (насичені вуглеводні).
2.Приєднання галогенів. Алкени легко за звичайних умов вступають у реакції з хлором та бромом з утворенням відповідних дигалогеналканів, у яких атоми галогену знаходяться біля сусідніх атомів Карбону.
При взаємодії алкенів з бромом спостерігається знебарвлення жовто-бурого забарвлення брому. Це одна із найстаріших та найпростіших якісних реакцій на ненасичені вуглеводні, оскільки аналогічно реагують також алкіни та алкадієни.
3. Приєднання галогеноводнів. При взаємодії етиленових вуглеводнів з галогеноводнями (HCl, HBr) утворюються галогеналкани, напрям реакції залежить від будови алкенів.У випадку етилену або симетричних алкенів реакція приєднання відбувається однозначно і веде до утворення лише одного продукту:
У випадку несиметричних алкенів можливе утворення двох різних продукти реакції приєднання:
Насправді переважно утворюється лише один продукт реакції. Закономірність напрямку проходження таких реакцій встановив російський хімік В.В. Марковніков у 1869 р. Вона носить назву правило Марковнікова: при взаємодії галогеноводнів з несиметричними алкенами атом Гідрогену приєднується за місцем розриву подвійного зв’язку до найбільш гідрованого атома Карбону, тобто до того, що з’єднаний з більшою кількістю атомів Гідрогену.Дане правило Марковніков сформулював на основі експериментальних даних і тільки значно пізніше воно одержало теоретичне обґрунтування.
4. Приєднання води. Алкени приєднують воду у присутності кислотних каталізаторів. Найчастіше використовують сульфатну або ортофосфатну кислоти. Продуктами реакції є спирти:
5. Окиснення. Алкени, на відміну від алканів, легко вступають в реакції окиснення. Так, етиленові вуглеводні при кімнатній температурі окиснюються калій перманганатом (реакція Вагнера). При обробці алкенів розбавленим розчином KMnO4 утворюються двоатомні спирти, які містять дві гідроксильні групи:
Ця реакція має аналітичне значення, оскільки при її проходженні фіолетовий розчин калій перманганату знебарвлюється. Так само як і реакція з бромною водою вона є якісною на ненасичені вуглеводні.
6. Реакції полімеризації. Органічні сполуки з кратними зв’язками здатні сполучатись між собою з утворенням довгих ланцюгових молекул. Якщо дві молекули сполучаються між собою, то продуктом реакції є димер, якщо три – тример і т.д. Сполучення великої кількості молекул між собою веде до утворення полімеру (гр. poly – багато, meros – частина). Так молекули етилену внаслідок розриву подвійного зв’язку здатні зв’язуватись між собою з утворенням поліетилену:
3. Загальна характеристика алкінів.
Алкі́ни, ацетиле́нові вуглево́дні, члени групи вуглеводнів із загальною формулою CnH2n-2. Ацетилен, пропін – за нормальних умов гази, алкіни складу С4 – С16 – тверді речовини. Всі ацетиленові вуглеводні – безбарвні речовини, практично не розчинні у воді, але добре розчинні в органічних розчинниках.
Хімічні властивості алкінів
1.Гідрування алкінів. Приєднання водню до алкінів відбувається ступінчато. На першій стадії гідрування ацетилен перетворюється в етилен, який далі утворює етан:
Гідрування алкінів можна зупинити на стадії утворення алкенів, але більшість каталізаторів, які використовують у цій реакції не дозволяє це зробити і алкіни відновлюються одразу до алканів.
2.Приєднання галогенів. Алкіни, подібно до алкенів, при кімнатній температурі взаємодіють з галогенами (хлором, бромом), при цьому вони послідовно приєднують дві молекули галогену:
]Знебарвлення жовто-бурого забарвлення бромної води є якісною реакцією на потрійний зв’язок.
3.Приєднання галогеноводнів. Алкіни приєднують одну або дві молекули галогеноводню (HCl, HBr). Реакція відбувається за наявності каталізатора (CuCl, CuBr, HgCl2 та ін.), в результаті утворюється відповідно моно- або дигалогенопохідні вуглеводнів. Приєднання другої молекули галогеноводню відбувається відповідно до правила Марковнікова:
4. Гідратація алкінів (реакція Кучерова). Вода приєднується до алкінів у кислому середовищі в присутності солей меркурію (II). Цю реакцію відкрив у 1881 р. російський хімік М.Г. Кучеров. Він вперше добув таким шляхом оцтовий альдегід із ацетилену, і показав, що ця реакція є загальною для класу алкінів.
5. Утворення ацетиленідів. Алкіни вступають у реакції заміщення. Вони утворюють солі, які називаютьсяацетиленідами. Атом Гідрогену біля атома Карбону з потрійним зв’язком заміщується на метал:
СН≡СН + 2NaNH2 → Na–C≡С–Na + 2NH3
натрій ацетиленід
СН≡СН + 2[Cu(NH3)2]OH → Cu–C≡С–Cu + 4NH3 + 2H2O
купрум (І) ацетиленід
6. Окиснення. Подібно до алкенів, алкіни вступають в реакцію окиснення з калій перманганатом, калій дихроматом, хром (VI) оксидом в кислому середовищі. При окисненні ацетилену калій перманганатом утворюється щавлева кислота:
7. Димеризація та тримеризація алкінів. Ацетилен під впливом солей купруму (І) в кислому середовищі димеризується з утворенням вінілацетилену:
Циклотримеризація ацетилену в присутності каталізаторів призводить до утворення бензену:
4. Загальна характеристика алкадієнів.
Алкадієни – це вуглеводні з відкритим ланцюгом, які містять два подвійних –С=С–зв’язки. Алкадієни мають загальну формулу CnH2n-2(молекулярні ізомери алкінів) та утворюють гомологічний ряд.
Залежно від взаємного розташування подвійних зв’язків у молекулі алкадієну всі вуглеводні, цього класу поділяють на три групи:
Алкадієни з кумульованими подвійними зв’язками – у них подвійні зв’язки розташовані біля одного атома Карбону. Найпростішим представником цієї групи дієнів є арен (пропадієн-1,2) СН2=СН=СН2, тому їх називають аренами.
Алкідієни із кон’югованими подвійними зв’язками – у них подвійні зв’язки розділені одним простим зв’язком. Спрощено їх називають кон’югованими дієнами. Найпростішим представником є бутадієн-1,3 або дивініл СН2=СН‑СН=СН2.
Алкадієни з ізольованими подвійними зв’язками – у них подвійні зв’язки перебувають один від одного на відстані двох або більше простих зв’язків.
Найпростішим представником цієї групи дієнів є пентадієн-1,4 СН2=СН‑СН2‑СН=СН2.
За систематичною номенклатурою назва алканів має наступну структуру: замісники + головний ланцюг + закінчення –дієн.
5. Загальна характеристика аренів.
Арени або ароматичні вуглеводні – це сполуки, молекули яких містять стійкі циклічні групи атомів (бензенові ядра) з особливим характером хімічних зв'язків.

Прості представники (одноядерні арени): бензин.
Багатоядерні арени: нафталін С10Н8, антрацен С14Н10 і ін.
Термін "ароматичні сполуки" виник давно у зв'язку з тим, що деякі представники цього ряду речовин мають приємний запах. Проте в даний час в поняття "ароматична" вкладається абсолютно інший сенс.
Фізичні властивості
Бензен та перші члени гомологічного ряду (толуен, етилбензен та ін.) здебільшого прозорі рідини зі специфічним запахом. Вони не розчинні у воді, але добре розчинні в органічних розчинниках. Арени горять кіптявим полум’ям через високий вміст Карбону в їх молекулах.
Хімічні властивості аренів
Для бензену найхарактернішими є реакції заміщення, однак, за певних умов бензен може вступати у реакції приєднання; для ароматичних вуглеводнів характерні також реакції окиснення.
V .Узагальнення. систематизація й контроль знань і вмінь студентів
Критерії оцінювання знань студентів
Дати відповіді на питання:
1. Дайте загальну характеристику алканам.
2. Які фізичні властивості притаманні для алкенів?
3. Охарактеризуйте алкіни.
4. В які хімічні реакції вступають алкадієни7
5. Дайте загальну характеристику аренам.
Підведення підсумків заняття
На основі отриманих знань студенти роблять відповідні висновки.
VI. Повідомлення домашнього завдання
Вивчити ǵ 24 ст. 111 – 115, с.116 – 121, с.131 – 138 підручника, конспект заняття.

%2B-%2B%D0%BA%D0%BE%D0%BF%D0%B8%D1%8F.jpg)
Комментариев нет:
Отправить комментарий